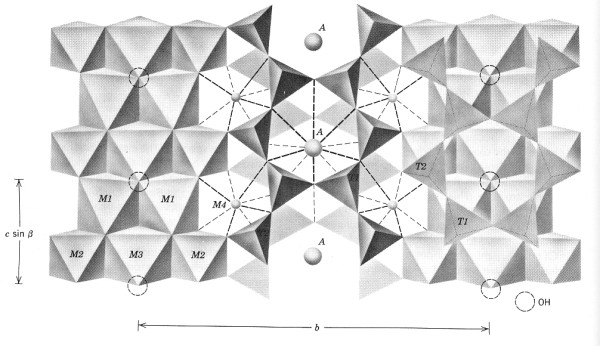
Koordinační polyedr aniontů se tvoří kolem kationtu, vzdálenost aniont - kationt je určena součtem iontových poloměrů a koordinační číslo kationtu poměrem poloměrů kationt - aniont.
Princip elektrostatické valence. Ve stabilních krystalových strukturách
je celková pevnost valenčních vazeb, které sahají k okolním aniontům,
rovna náboji aniontu. Pevnost elektrostatické vazby (též Paulingova vazebná
síla) lze definovat jako náboj iontu dělený koordinačním číslem. Výsledné
číslo se také označuje jako elektrostatická valence. Např. v halitu
je iont Na+ obklopen šesti anionty Cl-, takže každá z 6
vazeb má sílu 1/6. Tím se míní, že šest vazeb mezi centrálním kationtem
a šesti oktaedricky koordinovanými anionty jsou navenek elektricky neutrální.
Krystaly, ve kterých mají všechny vazby stejnou pevnost, se označují jako
izodesmické.

Existence společných hran a nebo stěn dvou polyedrů snižuje celkovou
stabilitu struktury. Tento efekt je větší pro velké kationty s vysokou
valencí a nízkým koordinačním číslem a také v případech, kdy se
poměr iontů blíží dolnímu limitu stability koordinačních polyedrů.
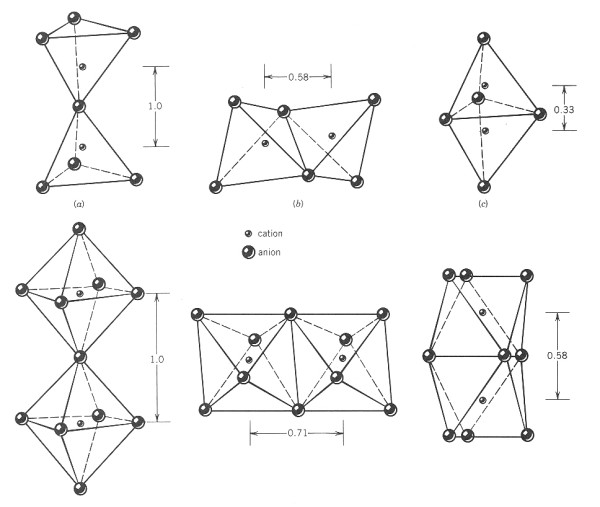
V krystalech s různými kationty, které mají vysokou valenci a nízké koordinační číslo, je tendence nesdílet navzájem prvky polyedrů. Pokud k tomu dojde, sdílené hrany se smršťují a kationty jsou vychýleny ze svých centrálních poloh v polyedru, dále od sdílené hrany nebo plochy.
Princip „šetrnosti“. Počet druhů základních stavebních jednotek
v krystalu bývá co nejmenší, obvykle jen několik rozdílných typů
kationtových a aniontových pozic. Ve strukturách s komplikovaným složením
mohou různé ionty obsazovat stejné strukturní pozice (viz následující
struktura amfibolu).